当センターの岡本泰昌教授、市川奈穂特任助教を始めとした、国際電気通信基礎技術研究所(ATR) 脳情報通信総合研究所、量子科学技術研究開発機構(QST)、昭和大学、慶應大学、京都大学、東京大学の研究グループは、安静時に撮像された機能的磁気共鳴画像(fMRI)データを基に、うつ病の中核群とされるメランコリア特徴を伴う[1]うつ病を判別する方法(うつ病バイオマーカー)の開発と、抗うつ薬治療による脳機能結合の変化の違いを明らかにすることに成功し、国際誌「Scientific Reports」に掲載されました(本学プレスリリース)。
これにより、MRI検査によるうつ病の中核群の判定や、抗うつ薬による変化がみられない脳機能結合へのアプローチにより、新たなうつ病の治療法開発が期待されます。

世界保健機関(WHO)の報告では、2030年にはうつ病が世界的に疾病負荷の第一位となることが予測されています。 その一方で、薬物療法や精神療法を受ける3分の2の症例が完全に反応せず、治療に反応した2分の1しか寛解を維持しないなど、薬物治療の限界が報告されており、新たな治療法の開発が喫緊の課題です。
本研究では、精神疾患簡易構造化面接法(MINI)[2]により判定したうつ病患者92名と年齢性別を合わせた健常者92名のうち、メランコリア特徴を伴ううつ病65名と健常者65名の計130名の安静時脳機能結合データ[3]を対象として、人工知能(AI)、複数の機械学習アルゴリズム[4]を適用することにより、メランコリア特徴を伴ううつ病バイオマーカー開発を行いました。
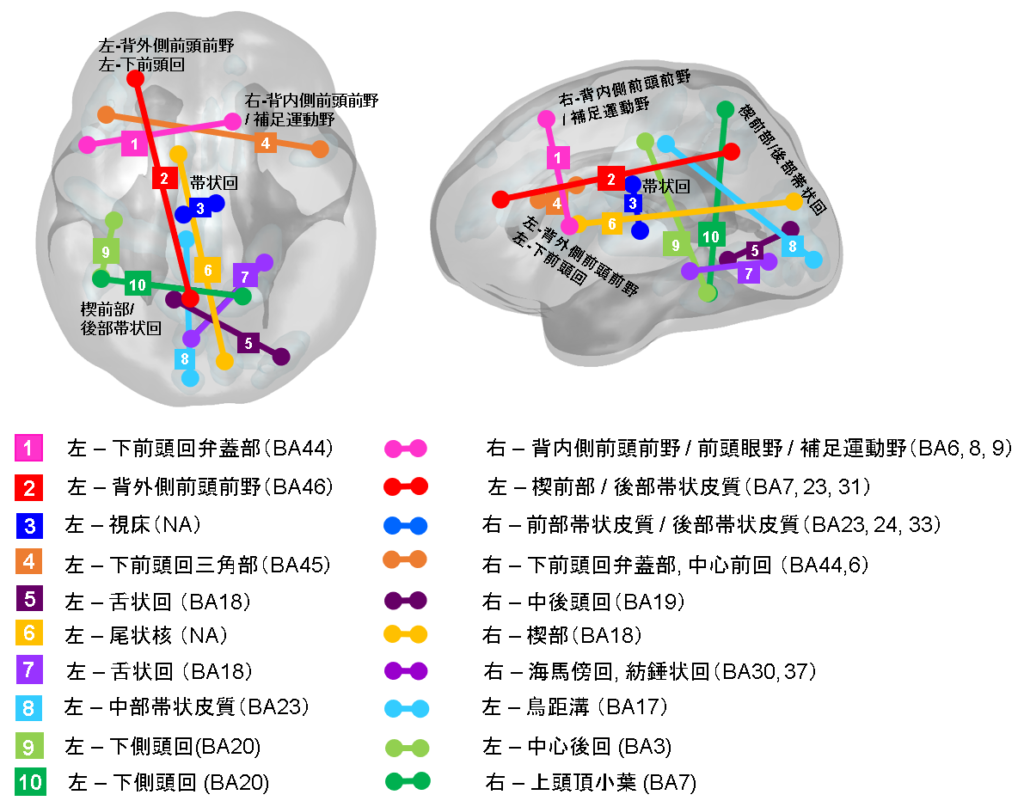
被験者の脳機能活動は3テスラのMRI装置により約10分間撮像し、撮像中はモニター中央に表示される十字マークを見ながら安静にして眠らないように教示しました。脳機能画像解析は、脳溝アトラスに従って全脳137領域から時系列データを抽出し、時系列相関をまとめた相関行列データ(9316の特徴量)を個人毎に作成しました。全脳より得られた脳機能結合から、10個の脳機能結合がメランコリア特徴を伴ううつ病バイオマーカーとして抽出されました。このバイオマーカー(判別器)を用いてメランコリア特徴を伴ううつ病が判別率84% (AUC 0.91)[5]と高い精度で判別できました。この判別器は、異なる施設の独立したデータセットでも有意な判別精度(汎化性能)[6]を示しました。さらに治療開始後6-8週[7]に再撮像を行った一部の症例において抗うつ薬である選択的セロトニン再取り込み阻害薬(SSRI) [8]の治療による変化についての検討したところ、10個の脳機能結合のうち、変化がみられない結合(左背外側前頭前野と後部帯状回/楔前部の機能結合[9])が存在することが明らかになりました。
本研究は、全脳データからうつ病の中核群とされるメランコリア特徴を伴ううつ病に特異的な安静時脳機能結合を抽出しAIを用いて高い精度で判定できること、また、抗うつ薬治療により変化がみられない脳機能結合が存在することを初めて明らかにした研究です。
【参考】
[1] “メランコリア特徴”を伴ううつ病
“メランコリア特徴”を伴ううつ病は、様々なサブタイプも指摘されるうつ病において、生物学的均質性が高く、うつ病の中核群と考えられています。
DSM−5精神疾患の診断・統計マニュアル第5版(2014)によれば、メランコリア特徴は以下のように説明されます。
A.現在のエピソードの最も重度な期間に、以下のうち1つが存在する:
1.全ての、またはほとんどすべての活動における喜びの喪失
2.普段快適である刺激に対する反応の消失(何かよいことが起こった場合にも一時的にさえ、ずっとよい気分にならない)
B.以下のうつ3つ(またはそれ以上):
1.はっきりと他と区別できる性質の抑うつ気分があり、深い落胆、絶望、および/または陰鬱さ、またはいわゆる空虚感によって特徴づけられる
2.抑うつは決まって朝に悪化する
3.早朝覚醒(すなわち、通常の起床時間より少なくとも2時間早い)
4.著しい精神運動焦燥または制止
5.有意な食欲不振または体重減少
6.過度または不適切な罪悪感
[2] 精神疾患簡易構造化面接法(MINI)
精神障害の診断のための短時間で施行可能な構造化面接。標準化された質問項目を用いながら、約15分程度で実施可能です。
[3] 安静時脳機能結合
脳は安静状態にあっても自発的な活動を行っています。これを機能的MRIで計測すると、脳活動状態を表す信号値(BOLD信号値)が時間の経過とともにゆらぐ現象として観察されます。本研究では、その長周期成分(周期10秒以上)に着目してうつ病に特徴的な時間的変動の検出を目指し、脳活動を反映するMRI信号(BOLD信号)の時間的変動の相関係数から評価を行いました。相関係数は、2領域間の脳活動の類似性が高いと1に近い値に、互いを抑制しあう関係では-1に近い値に、互いに関連しないとき0に近い値を取ります。
本研究では、137個の各脳部位から信号波形を取り出し、全ての脳部位ペア(9,316組)について相関係数を求めることで、個人の全脳にわたる機能的結合情報を含んだ脳の機能的回路図を得ました。それぞれの要素が-1から1の間の値を取る、9,730次元のベクトルを人工知能技術で(メランコリア特徴を伴う)うつ病か否かの2つのクラスに分類します。
[4] 人工知能(Artificial Intelligence;AI)、複数の機械学習アルゴリズム
特徴量の絞り込みを効率よく行うアルゴリズムとして、正則化スパース正準相関分析(L1-SCCA)とスパースロジスティック回帰(SLR)という二つの方法を組み合わせる革新的人工知能技術を開発し、オーバーフィッティング現象が起こりにくい工夫を加えながら、内部・外部双方のデータについて高い精度が得られる判別器の開発が可能となりました。この技術を用いて、すでに自閉症のバイオマーカーを開発しています (Yahata et al., A small number of abnormal brain connections predicts adult autism spectrum disorder, Nature communications 2016)。
[5] AUC (Area Under the Curve)
疾患群・健常群などの2値分類を行う手法の精度を評価する指標です。0~1の値をとり、1に近づけば近づくほど優れた分類方法であることを表します。0.9~1.0は高精度、0.7~0.9は中程度、0.5~0.7は精度が低いとされます。
[6] 外部独立データにおける有意な判別精度(汎化性能)
本研究プログラムでは、人間の学習と同じように、少数個のサンプルからでも学習し、汎化能力を担保できる革新的な人工知能技術を開発しました。
現在主流の人工知能技術(たとえば深層学習ニューラルネットワークなど)には、ビッグデータが必須で、従来技術ではデータ次元の少なくとも10倍のサンプルが必要とされています。
精神科領域や脳科学の領域でも、MRI画像から得られる指標をもとに精神疾患状態を判別する試みはこれまでにも多数ありましたが、これらには数十・数百といった小規模のサンプルしか用いられていませんでした。このため、研究用に集められた少ないデータについては高精度に判別できても、任意の外部データに対する精度は未検証であったか、統計的に意味のある精度に及んでいなかった(正答率50%と言う場合もある)とも言われます。この理由としては、判別法の開発段階で、疾患属性とは関係のないデータを含む特性までを取り込んだ機械学習が行われた結果、外部データへの汎化性能が悪くなること(オーバーフィッティング現象)が考えられます。
[7] 治療開始後6-8週
一般的に、抗うつ薬によるうつ症状の改善度の評価は、投薬治療を6週間以上行った後に実施します。そのため、抗うつ薬治療による脳活動の変化について、治療開始後6-8週の間に撮像したfMRIデータを用いて検討を行いました。
[8] 選択的セロトニン再取り込み阻害薬(SSRI)
うつ病治療において、標準的に使用される抗うつ薬の一つです。選択的セロトニン再取り込み阻害薬(SSRI)は、シナプスにおけるセロトニンの再取り込み阻害作用を共通の薬理学的特徴として持っています。一般的に抗うつ効果発現までには4-6週間はかかることが多く、解決すべき大きな問題とされています。
[9]脳の部位について
・左背外側前頭前野 (Left dorsolateral prefrontal cortex: L-DLPFC)
意思決定やワーキングメモリ(作業記憶と呼ばれる短期記憶)、社会的認知や、認知的柔軟性などの機能と関連しています。課題時の脳機能活動として現れる実行制御ネットワーク(Executive Control Network; ECN)において中心的な脳領域です。
・後部帯状回/楔前部 (Posterior cingulate cortex: PCC / Precuneus)
感情や記憶、内発的な制御、注意の集中などの機能に関連しています。安静時の脳機能活動として現れるデフォルトモードネットワーク(Default Mode Network; DMN)における中心的な脳領域です。
【論文】
掲載誌: Scientific Reports
論文タイトル: Primary functional brain connections associated with melancholic major depressive disorder and modulation by antidepressants(メランコリー型うつ病に関わる脳機能結合と抗うつ薬による変化)
著者名: Ichikawa N1, Lisi G2, Yahata N3, Okada G1, Takamura M1, Hashimoto R4, Yamada T2, Yamada M3, Suhara T3, Moriguchi S5, Mimura M5, Yoshihara Y6, Takahashi H7, Kasai K8, Kato N4, Yamawaki S1, Seymour B2,9, Kawato M2, Morimoto J2, Okamoto Y1*
所属:1広島大学大学院、2国際電気通信基礎技術研究所(ATR)、3量子科学技術研究開発機構、4昭和大学、5慶應義塾大学、6京都大学、7東京医科歯科大学、8東京大学、9ケンブリッジ大学
【研究サポート】
AMED:国際脳(JP19dm0307002、JP19dm0307008)、脳プロBMI(JP17dm0107044)、融合脳(JP19dm0107093)、脳プロF、革新脳






